A savoir
Les métaux sont nécessaires au bon fonctionnement de notre organisme. Ils sont présents sous forme d'ions en faible quantité (oligoéléments).
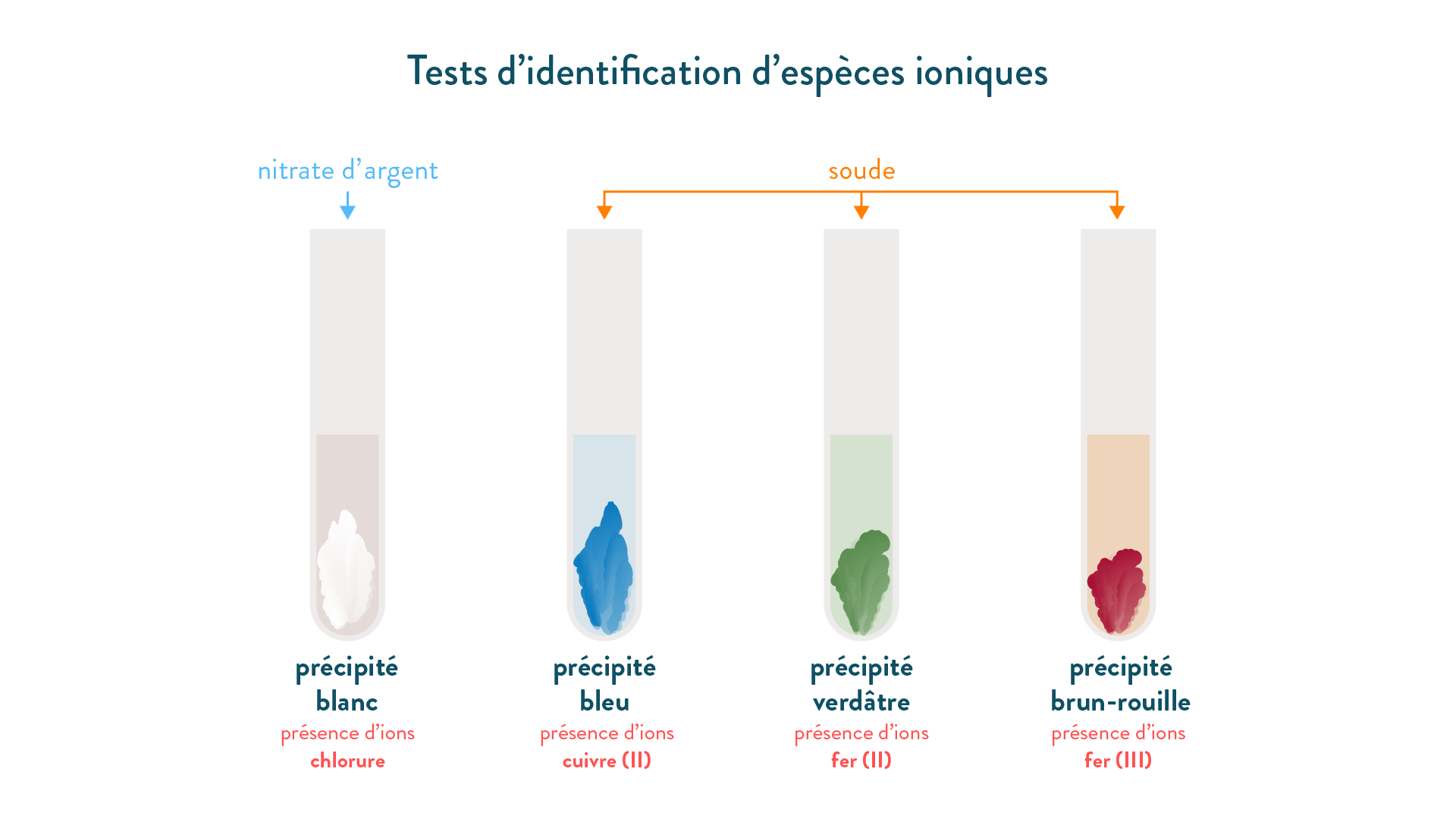
Pour détecter la présence d'un ion dans une solution, on réalise un test d'identification en versant quelques gouttes d'un détecteur approprié.
Si on observe la formation du précipité coloré attendu alors on peut conclure que l'ion recherché est présent.
Image pour illustrer (ne pas copier).
Exemples et/ou Activités 

Activité 1 : Comprendre un exemple
Je verse quelques gouttes de soude (hydroxyde de sodium) dans une solution inconnue.
Observation :
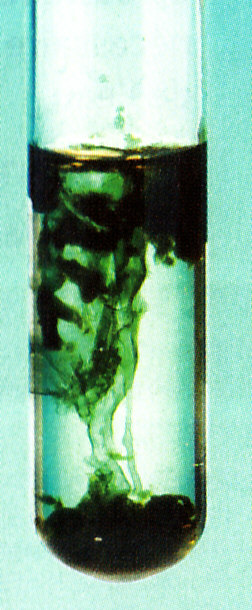
Je vois apparaitre unprécipité vert.
Conclusion :
Je peux conclure que la solution inconnue contient les ions fer II : les ions hydroxyde que j'ai versé avec le réactif ont trouvé des ions ferII qui étaient présents dans la solution inconnue et cela a formé un précipité vert.
Activité 2 : S'exercer, réaliser des tests d'identification
Identification de quelques ions (site collegephysiquechimie)
Enquête scientifique : Qui est le coupable ? (site collegephysiquechimie)
Récapitulatif : Comment déceler la présence de certains ions dans une solution inconnue ?
Formation d'un précipitéL'ajout de
nitrate d'argent permet de déceler la présence des ions chlorure Cl
-.
L'ajout de
soude (hydroxyde de sodium) permet de déceler la présence des ions cuivre II, fer II ou fer III.
Tableau présentant quelques ions, leur détecteur et la couleur du précipité attendu.
| Nom | ion chlorure | ion cuivre II | ion fer II | ion fer III |
|---|
| Formule | Cl- | Cu2+ | Fe2+ | Fe3+ |
|---|
| Détecteur | nitrate d'argent |
soude
(hydroxyde de sodium) |
|---|
| Couleur du précipité | précipité blanc | précipité bleu | précipité vert | précipité rouille |
|---|
Exercices

DeduirePresenceIons1 :
Déduire la présence ou l'absence d'ions
chlorure, cuivre II, fer II, fer III, hydrogène ou hydroxyde
d'après l'observation d'un test d'identification.




